Par Olivier Petitjean
Mis en ligne le 20 décembre 2018
En apparence, le prix des médicaments en France est fortement régulé par les pouvoirs publics. En réalité, les industriels savent jouer de tous les leviers pour s’assurer des conditions très favorables.
La hausse vertigineuse du coût des nouveaux médicaments pourrait avoir de lourdes conséquences sur notre système de santé. Comment sont décidés les prix des nouveaux médicaments et leur taux de remboursement par la sécurité sociale ? Contrairement aux États-Unis, où les laboratoires pharmaceutiques sont libres de fixer leurs propres prix – quitte à devoir négocier ensuite des remises avec les compagnies d’assurance ou les fournisseurs de santé –, la France a mis en place une procédure fortement réglementée, avec plusieurs étapes administratives. Ce qui ne signifie pas que le processus soit transparent, ni protégé de l’influence des industriels. Au contraire : ces derniers savent jouer de tous les leviers pour peser sur les décisions finales, au détriment de l’intérêt général.
Elle est généralement délivrée soit en France par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM), soit au niveau européen par l’Agence européenne du médicament. L’autorisation de mise sur le marché (AMM) permet la commercialisation du médicament pour une ou plusieurs indications thérapeutiques, sur la base d’un dossier fourni par le laboratoire permettant d’évaluer les risques éventuels. Ce dossier comprend des informations sur le produit et son principe actif, ainsi que sur les essais pré-cliniques (sur les animaux) et cliniques (sur les humains).
Les experts ont souvent des liens plus ou moins étroits avec l’industrie.
Pour évaluer le dossier et rendre leurs décisions, ces agences s’appuient sur des groupes d’experts. Ces derniers doivent remplir des déclarations d’intérêt (pour celles qui concernent l’Agence nationale de sécurité du médicament et des produits de santé, voir le site dpi.sante.gouv.fr), dont la lecture montre qu’ils ont souvent des liens plus ou moins étroits avec l’industrie. Les nombreux conflits d’intérêts qui caractérisent le fonctionnement de l’EMA ont été régulièrement mis en cause, y compris au sein même des institutions européennes.
La Commission de transparence de la Haute autorité de santé (HAS) octroie deux « notes » au médicament, qui influeront sur son prix futur :
En 2017, la Commission de transparence a ainsi évalué 53 nouveaux médicaments. Elle a jugé que 45 d’entre eux rendaient un service médical (et donc pouvait être remboursés). 40 présentaient une ASMR 5 (nulle), 11 une ASMR 4 (mineure), 2 une ASMR 3 (modérée), et aucune une ASMR 1 ou 2. En 2017, l’innovation dont ont fait preuve les laboratoires pharmaceutiques en matière d’amélioration du « service médical » est donc assez limitée.
Aucun médicament évalué en 2017 ne présentait d’amélioration du service médical rendu supérieure à « modérée ».
Cette commission de transparence est composée de vingt professionnels de santé « choisis principalement en raison de leur compétence scientifique dans le domaine du médicament » et d’un représentant d’associations de malades et d’usagers du système de santé (à quoi s’ajoutent des membres suppléants). Leurs déclarations d’intérêts sont également disponibles sur le site dpi.sante.gouv.fr.
L’évaluation de l’ASMR au sein de la Haute autorité de santé a été marquée par plusieurs affaires de conflits d’intérêts patents, documentés notamment par Mediapart (2). Au-delà de ces cas extrêmes, le choix du comparateur, c’est-à-dire le médicament déjà sur le marché auquel le nouveau médicament va être comparé, pose question. Ce processus est souvent opaque. Lorsqu’il n’y a pas du tout de comparateur – ce qui est le cas pour les maladies orphelines mais aussi de plus en plus pour les traitements dits « innovants » poussés actuellement par les laboratoires –, la note d’ASMR peut être élevée même alors que l’efficacité du traitement est limitée.
C’est une nouvelle étape de la procédure introduite en 2012. Elle est obligatoire pour les traitements d’ASMR de 1 à 3 « susceptibles d’avoir un impact significatif sur les dépenses d’assurance maladie », et régulièrement appliquée aux autres. La Commission d’évaluation économique et de santé publique (CEESP), elle aussi hébergée au sein de la Haute autorité de santé, réunit des professionnels de santé, des économistes, et des représentants des malades et des usagers. Elle rend un « avis d’efficience » (coût/efficacité) tenant compte des impacts positifs ou négatifs plus larges d’un médicament pour le patient et l’organisation des soins. Cette efficience se mesure essentiellement en « années de vie en bonne santé » (« Qaly », pour quality adjusted life years), indicateur complété par des considérations éthiques. Là encore, l’avis est rendu sur la base d’un dossier et de données fournies par le laboratoire. La Haute autorité de santé a plusieurs fois souligné la mauvaise qualité de ces dossiers.
Contrairement à ce qui se passe dans d’autres pays européens, ce n’est pas la sécurité sociale qui négocie le prix des médicaments et leur taux de remboursement, mais un comité interministériel, placé sous l’autorité conjointe du ministère de la Santé et du ministère de l’Économie (3) : le Comité économique des produits de santé (CEPS). Théoriquement, le prix de chaque médicament est fixé en fonction des avis de la Haute autorité de santé (ASMR et avis d’efficience), ainsi que de considérations commerciales : un médicament destiné à un petit nombre de patients, par exemple, pourra être vendu plus cher qu’un autre appelé à être commercialisé massivement.
L’opacité du CEPS et de ses décisions sont souvent décriées.
Le CEPS est composé de hauts fonctionnaires des deux ministères, ainsi que de représentants de la Caisse nationale d’assurance maladie et des mutuelles, dont les déclarations publiques d’intérêt sont elles aussi disponibles sur dpi.sante.gouv.fr. L’industrie pharmaceutique, par contre, n’y siège pas, ni aucune des autres parties prenantes du système de santé. Est-ce à dire que les délibérations s’y déroulent de manière transparente, avec pour seule priorité l’intérêt général ? Bien au contraire, l’opacité du CEPS et de ses décisions sont souvent décriées. Celui-ci se retrouve souvent contraint d’accepter des prix relativement élevés même pour des médicaments dont l’ASMR est faible, comme le relève encore le rapport 2017 de la Cour des comptes sur le financement de la sécurité sociale. Un exemple souvent cité est celui du Crestor, une statine très coûteuse pour la sécurité sociale, qui a obtenu un prix quatre fois supérieur à celui d’autres médicaments génériques similaires, sans amélioration du service médical rendu.
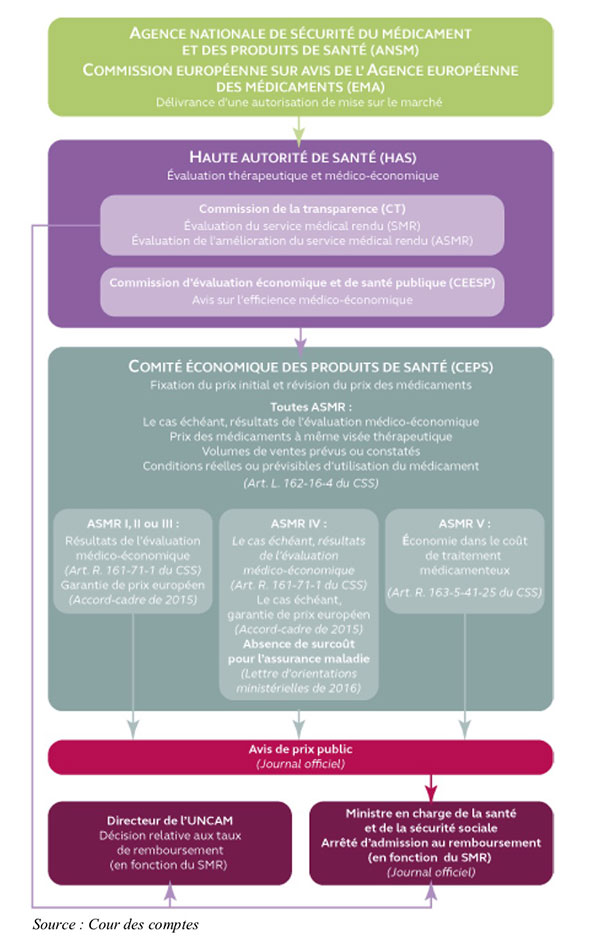
Pourquoi l’autorité politique valide-t-elle des prix élevés qui ne correspondent pas forcément aux avis rendus lors des étapes précédentes d’évaluation ? Tout d’abord, la double tutelle du Comité et sa composition signifient bien que les économies pour la sécurité sociale ne sont pas sa seule priorité : le CEPS poursuit également des objectifs d’accès aux soins et de soutien à l’industrie pharmaceutique nationale et à sa « compétitivité ». Bref, les pouvoirs publics ne parlent pas d’une seule voix face aux labos, voire pour certains abondent dans le sens de ces derniers. Le rapport 2017 de la Cour des comptes relève plusieurs cas où l’argument de l’emploi et de l’investissement a été ouvertement utilisé par un fabricant de médicament pour maintenir un prix relativement élevé. Les décisions du CEPS sont également soumises à des pressions extérieures, comme celles des associations de malades : « Nous n’avons pas besoin d’avoir un droit de décision au CEPS pour peser dans les négociations afin que les dispositifs médicaux innovants soient remboursés », nous déclarait ainsi récemment le président de la Fédération française des diabétiques (lire « Les associations de patients, des alliés précieux pour l’industrie du médicament et des implants »).
Ensuite, les pouvoirs publics ont choisi dans les faits de négocier les prix au cas par cas avec chaque laboratoire, dans le cadre d’un « accord-cadre » de trois ans signé avec Les entreprises du médicament (LEEM), à la fois lobby et association patronale du secteur pharmaceutique en France. Cet accord-cadre doit être renouvelé fin 2018. C’est donc plutôt une « cogestion » public-privé, où les pouvoirs publics choisissent en quelque sorte de se lier les mains a priori. L’une des dispositions les plus contestées de l’accord-cadre est le comparateur de prix européen (obligatoire pour les médicaments d’ASMR 1 à 3, mais appliqué de fait à tous ou presque), par lequel le CEPS s’oblige à fixer un prix similaire à celui pratiqué en Grande-Bretagne, en Allemagne, en Italie et en Espagne. Double problème : les labos ont tendance à soumettre d’abord leurs nouveaux médicaments en Grande-Bretagne, où les prix sont libres et plus élevés ; et surtout, la comparaison se base sur les prix dits « faciaux », c’est-à-dire théoriques, sans tenir compte des remises confidentielles accordées pays par pays par les industriels. Signe du caractère sensible de ce mécanisme : lorsque le CEPS a voulu y mettre fin lors de la renégociation de l’accord-cadre en 2012, le LEEM a menacé de claquer la porte.
Les pouvoirs publics ont en quelque sorte choisi de se lier les mains a priori.
La Cour des comptes relève également le manque de ressources du CEPS : seulement 13 équivalents temps plein, alors que les autorités de régulation des secteurs de l’énergie ou des télécommunications en ont dix fois plus. Le Comité est également très dépendant des données fournies par les laboratoires, sans moyens de les vérifier ou les contre-expertiser. Au final, donc, le rapport de forces semble très déséquilibré. D’autant que, selon le constat récent de deux chercheurs, le CEPS choisit d’accepter le marché des produits pharmaceutiques tels l’organisent les laboratoires, et de ne pas « intervenir sur le fonctionnement du marché lui-même » malgré les pouvoirs théoriques dont il dispose (4). Lorsque la négociation avec un laboratoire échoue, le CEPS a ainsi le pouvoir de fixer le prix unilatéralement. Dans la pratique, il ne l’a fait qu’une seule fois, en 2016, pour des génériques.
Le processus de fixation des prix est rendu plus complexe encore par les mécanismes de remise. Exemple ? Les laboratoires négocient avec le CEPS pour fixer un prix officiel le plus élevé possible. Dans le cadre de cette négociation, ils vont secrètement s’engager à reverser une partie de leurs revenus à l’assurance maladie. Le montant de ces transactions est confidentiel, ce qui permet aux laboratoires de négocier ensuite avec les autres gouvernements sur une base faussée.
En théorie, les ristournes secrètes consenties par les laboratoires devraient être temporaires.
D’autres formes de remises, tout aussi opaques, viennent s’ajouter à ce dispositif ancien. Par exemple des clauses de sauvegarde activées quand un labo dépasse un certain volume de ventes ou un seuil de chiffre d’affaires sur une pathologie. En clair, si le médicament en question se vend bien, le labo acceptera de reverser une partie à l’assurance maladie. Ou encore des contrats dits de « partage des risques », par lesquels le CEPS accepte de donner un prix élevé à un médicament présenté comme « innovant » par son producteur, à condition que ce prix puisse être revu à la baisse cinq ans plus tard si les bénéfices thérapeutiques ne se matérialisent pas. Selon la Cour des comptes, presque aucun des médicaments concernés par ce mécanisme ne s’est révélé probant à l’usage, sans que leur prix ait ensuite baissé significativement pour autant.
En 2017, toutes ces ristournes s’élevaient à presque un milliard d’euros. En théorie, ces mécanismes sont temporaires, et doivent se transformer en réduction pérenne du prix facial des médicaments concernés. En pratique, le recours aux ristournes tend à devenir structurel.
Dans un contexte où les laboratoires pharmaceutiques misent de plus en plus sur les médicaments dits « innovants » pour accroître leurs profits, tout le processus que nous venons de décrire tend à être de plus en plus contourné au profit d’un autre mécanisme, celui des Autorisations temporaires d’utilisation (ATU). L’idée est simple : lorsqu’un médicament promet d’apporter une avancée thérapeutique considérable pour des pathologies graves, il peut être utilisé rapidement sous certaines conditions avant même d’avoir obtenu son autorisation de mise sur le marché et de passer par les différentes étapes d’évaluation. En attendant que le processus « normal » soit parvenu à son terme, le laboratoire est libre de fixer son prix – appelé, dans ce cas, « indemnité » – à un niveau très élevé. Ce qui lui permet ensuite de peser sur les négociations avec le CEPS.
Les avancées thérapeutiques majeures annoncées par les laboratoires ne se matérialisent souvent pas.
La plupart des Autorisations temporaires d’utilisation finissent par être récusées, les avancées thérapeutiques majeures annoncées par les laboratoires ne se matérialisant pas. Face aux abus de cette procédure, les législateurs ont introduit certains seuils maximaux de coûts. Du côté des industriels en revanche, les ATU sont plébiscitées. Ils ont obtenu du Premier ministre Édouard Philippe en juillet 2018 un nouvel assouplissement de la procédure.
Même après que le CEPs a fixé le prix du médicament, les laboratoires disposent encore d’autres moyens pour accroître leurs profits. D’abord, profiter des bonnes relations qu’ils ont tissées avec les professionnels de santé et notamment avec certains « influenceurs » clés (lire « Immersion dans un congrès de formation de médecins sponsorisé par Big Pharma ») pour assurer une prescription massive de leur nouveau produit – bien plus massive, si possible, que ce qu’ils estimaient dans le dossier soumis au CEPS, lequel avait servi de base à la fixation du prix.
Un autre moyen fréquent de biaiser le processus est de commercialiser tout d’abord leur médicament avec une indication thérapeutique ciblant une population restreinte, pour convaincre le CEPS d’octroyer un prix élevé, puis de demander ensuite d’autres indications pour un nombre plus important de patients potentiels. Comme le relève la Cour des comptes, il n’existe pas de mécanisme systématique de révision des prix fixés par le CEPS à la lumière des extensions d’indication, ou encore de l’arrivée de nouveaux produits moins chers ou plus efficaces.
Il n’existe pas de mécanisme systématique de révision des prix fixés par le CEPS.
En fin de parcours, à l’expiration de leurs brevets, les laboratoires peuvent encore par divers moyens plus ou moins légaux freiner la concurrence et en particulier celle des copies génériques et biosimilaires nettement moins chères : extension artificielle de la durée des brevets au moyen de « certificats complémentaires de protection » (comme le laboratoire Gilead avec son Truvada (lire « L’histoire de la lutte contre le Sida montre qu’être offensif vis-à-vis des laboratoires ne se fait pas au détriment des patients, au contraire »), confidentialité ou exclusivité des données sur les essais cliniques empêchant une duplication facile de leurs produits, dénigrement des génériques, entente entre laboratoires... Au final, le secteur pharmaceutique et le prix des médicaments sont extrêmement régulés en France, comme le soulignent volontiers les industriels. Mais ces derniers ne manquent pas de moyens de manipuler le système à leur profit.