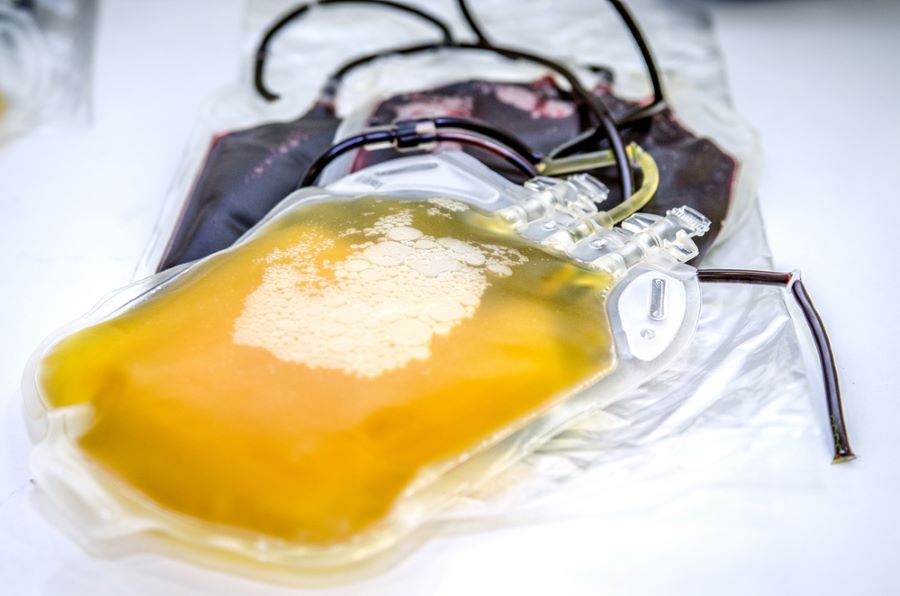
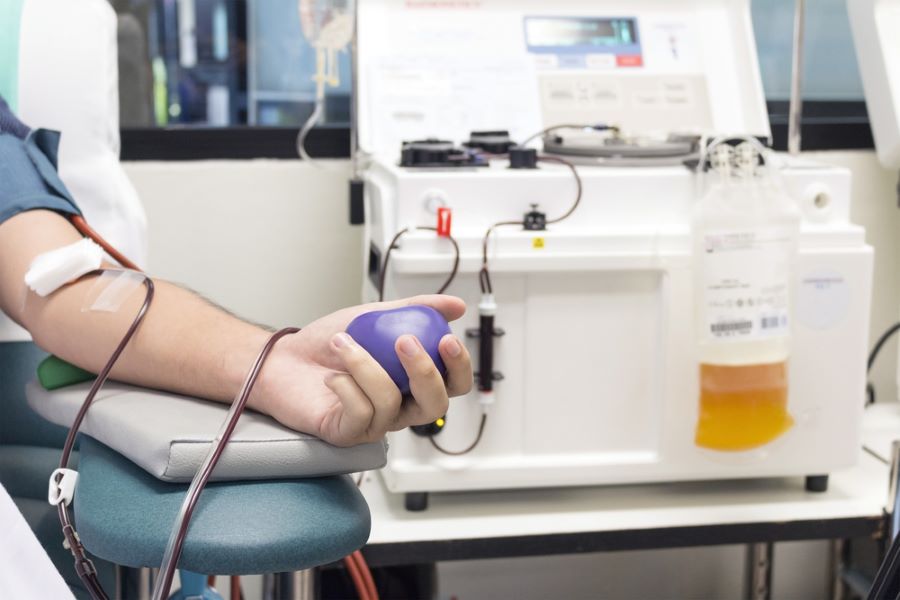
Dans le premier volet de notre enquête, nous révélions comment des particules noires ont été détectées, à travers le monde, sur les machines de don de plasma et de plaquettes de la société états-unienne Haemonetics. Elles sont issues d’un joint qui se décompose sous l’effet de la centrifugation. Ce joint est composé de silice, d’aluminium, de formaldéhyde, des produits cancérigènes et toxiques. Ces micro ou nano particules sont suspectées de se retrouver dans le sang des donneurs, mais aussi dans les produits transfusés à des malades (lire le premier volet de l’enquête).
De la société Haemonetics à l’Agence nationale de sécurité du médicament et des produits de santé (ANSM), notre enquête montre que le risque a été minimisé, au détriment de la protection des donneurs. Et que le problème des particules toxiques relâchées par ces machines est loin d’être résolu.
Haemonetics a-t-il tenté de minimiser le problème des particules ?
Le phénomène des particules issues des machines Haemonetics n’est pas nouveau. En 2011, il surgit en France et aux Pays-Bas, où une poche de plasma contenant des particules est transfusée à un patient. L’entreprise est sommée d’apporter une justification : du sang séché, déclare Haemonetics avant de parler de protéines. Cependant, quelques mois plus tard, dans un courrier adressé à ses clients, son médecin en chef Mark Popovsky reconnaît que ces particules peuvent provenir du joint de ses bols [1] tout en ajoutant que ces joints « correspondent aux standards de biocompatibilité ». Cette notion va régulièrement être utilisée pour certifier la non-dangerosité des particules.
En 2014, Haemonetics évite soigneusement d’évoquer devant les autorités ce qui préoccupe le plus l’entreprise : la défectuosité de son matériel qui peut conduire au relargage de particules. Plusieurs incidents viennent alors de se produire, en France, sur les machines de prélèvements de plaquettes. Le 14 mai 2014, au cours d’une réunion téléphonique de la société dont nous avons pu écouter un enregistrement, un responsable en charge de la recherche bio-médicale explique à ses collègues que le joint des machines de prélèvement de plaquettes, lorsqu’il est « mouillé », est en contact avec le sang. « Moi je dis, chaque fois qu’on mouille là, on est dans la merde, quoi, bien sûr qu’il faut pas en parler », explique-t-il.
Le responsable propose d’annoncer à l’Établissement français du sang (EFS) et à l’ANSM une modification des paramètres du logiciel pour éviter d’attirer l’attention sur les vibrations des machines.
« "La communication […] ce sera de dire : cause bol, circulez y’a rien à voir, faudra bien le tourner quand même. Cause centrifugeuse, circulez y’a rien à voir. Par contre on vous propose […] une reconfiguration du procédé.".[…] »
« Côté centrifugeuse, mon opinion c’est que je suis persuadé que 90% des MCS+ [les machines de prélèvement de plaquettes, ndlr] françaises, elles ont le couvercle mal ajusté, tout simplement parce qu’on l’a vérifié au moment où on avait les particules noires et qu’il n’y a pas de raison que ce soit amélioré depuis puisse qu’on a rien fait en gros »
*Un responsable d’Haemonetics. Citation extraite d’une conversation téléphonique.
« Haemonetics ne veut pas qu’on parle de la poussière et du joint », témoigne de son côté Alexandre Berthelot, dirigeant d’Haemonetics France à l’époque, qui assiste à la réunion. La version évoquée pendant cette conférence téléphonique, qui évite d’aborder le problème des défauts des machines, est celle qui sera présentée à l’ANSM et l’EFS à la fin du mois d’août 2014. En substance : il suffit d’ajuster le logiciel, et tout rentrera dans l’ordre.
Des mesures sont prises, mais les problèmes sur les machines persistent. « Quand je retourne sur le terrain, se souvient Jean-Philippe Urrecho, j’entends toujours des bruits de crissements, je constate des fuites, parfois des particules. Les infirmières mettent des poids sur les machines pour les empêcher de vibrer. Et personne ne le déclare. De toutes façons, quand il y a une déclaration, elle ne sert à rien. » Quelques mois plus tard, Alexandre Berthelot (ci-dessous en vidéo) et Jean-Philippe Urrecho, en conflit avec leur entreprise, sont licenciés et décident d’alerter l’EFS et l’ANSM sur les agissements d’Haemonetics.
Comment réagissent l’Etablissement français du sang et les autorités sanitaires ?
Les courriers des lanceurs d’alerte restent lettre morte pendant plusieurs mois. Du moins officiellement. En interne, le 29 décembre 2015, Stéphane Noël, alors directeur général délégué production et opérations à l’EFS s’en alarme :
L’ANSM est également informée. Mais il faut attendre début 2017 pour que de premières études soient diligentées sur ces particules noires. Les signalements d’incidents sont fouillés. Une étude réalisée par un laboratoire de Lyon (IBCP) indique la présence de débris du joint tournant dans les poches à plasma. Un comité d’experts (CSST), mandaté par l’ANSM, obtient la composition précise des joints des machines Haemonetics : il alerte l’ANSM sur les risques représentés par le matériel d’Haemonetics, par comparaison avec les autres machines mises sur le marché.
Pour aller plus loin dans son analyse, les experts du CSST demandent un accès à d’autres documents de l’entreprise. Mais l’ANSM interrompt sa mission. « Je n’avais pas conscience que la réunion d’octobre serait la dernière, au moins jusqu’à la parution du rapport bénéfices-risques, en décembre », nous explique un membre de ce comité d’experts. Plutôt que de poursuivre les investigations, l’ANSM produit un rapport bénéfices-risques favorable à la poursuite de l’utilisation des machines. « Il n’existe pas d’élément objectif qui remette en cause le bénéfice/risque y compris pour ce qui concerne les donneurs », conclut l’agence.
En résumé, les bénéfices de l’aphérèse sont pour l’ANSM supérieurs aux risques, minimes, que courent les donneurs. L’agence ajoute que la toxicité potentielle des particules n’est pas démontrée. Cela alors même que des particules d’aluminium, de chrome, de silice, ont été retrouvées dans des poches à plasma. « Une aberration médicale » selon Alexandre Berthelot, ancien dirigeant d’Haemonetics France :
« C’est une imposture intellectuelle », estime également Guylain Cabantous, syndicaliste CGT à l’EFS, qui découvre la problématique en février 2017. Un donneur peut-il prendre un risque en donnant son sang, ses plaquettes et son plasma ? Si ce risque est identifié, peut-on ne pas s’en soucier ? L’ANSM décide tout de même de mener des études complémentaires. En attendant, les machines restent sur le marché, et les informations délivrées aux donneurs, avant leur prélèvement, sont modifiées en janvier 2018. Le risque particulaire est évoqué, mais rien n’est dit sur la nature de ces particules.

Les trois lanceurs d’alerte portent plainte en mai 2018 pour « mise en danger de la vie d’autrui », « tromperie aggravée » et « inexécution d’une procédure de retrait ou de rappel d’un produit préjudiciable à la santé » [2]. Début septembre, la ministre de la Santé et des solidarités Agnès Buzyn reprend les arguments développés par l’ANSM [3]. Un arrêt des machines PCS+, celles qui prélèvent le plasma, « conduirait à une grave pénurie de plasma (pour lequel il n’existe qu’une alternative industrielle en matière d’aphérèse) pour le fractionnement », avance-t-elle. L’approvisionnement du marché en médicaments dérivés du sang est tendu, affirme le ministère.
Quelques jours plus tôt, un incident se produit à Tarbes : un bol fuit et projette des particules. Il sera suivi de trois autres incidents dans lesquels des particules noires sont signalées. L’EFS et l’ANSM décident finalement de suspendre les machines à plasma. Elles sont remplacées par celles d’un autre fournisseur, Fresenius, qui n’utilise pas le même procédé d’aphérèse qu’Haemonetics. En quelques jours, les autorités sanitaires ont viré de bord. Sans provoquer de grave pénurie de plasma.
Pourquoi les machines à plaquettes ne sont-elles, finalement, pas suspendues ?
Mais l’ANSM prend en fait une demi-mesure. Seules les machines à plasma ont été suspendues. Celles concernant les plaquettes, les MCS+, qui présentent les mêmes problèmes, sont toujours utilisées. « Nous n’avons pas rencontré de problématique de type particules pouvant mettre en danger un receveur ou un donneur », affirme Thierry Thomas, de l’ANSM. Pourtant, nos données révèlent que des particules noires ou des fuites de bols ont par exemple été signalées les 15 et 21 janvier 2019 à la Pitié Salpêtrière à Paris ; à l’hôpital Avicenne de Bobigny entre le 17 octobre 2018 et le 11 janvier 2019 ; à Orléans en mars ; à la Réunion entre mars et avril ; à la Martinique en février 2019. Dans ce dernier cas, des particules sont retrouvées dans la tubulure menant à la poche à plasma.

Une particule d’origine sanguine, affirme l’ANSM qui estime que les risques pour le donneur ont été maîtrisés. Des produits chimiques se trouvaient-ils coagulés avec le sang ? Cela est déjà arrivé mais le laboratoire les a-t-il recherchés ? « La balance bénéfices/risque de l’aphérèse reste largement positive », estime l’agence sanitaire à propos de cet incident qui ne figure donc pas, comme les autres incidents dont nous avons eu connaissance, dans la base de matériovigilance de l’ANSM. Pour l’institution, leur gravité est faible. « Nous n’avons pas été informés de cet incident sur ces machines », regrette de son côté Michel Monsellier, président de la Fédération des donneurs de sang bénévole.
« La balance bénéfices/risque de l’aphérèse reste largement positive » (ANSM)
Le problème est-il plus répandu ?
Notre enquête révèle aussi un déficit dans les remontées des signalements vers l’Établissement français du sang (EFS) et l’ANSM. Et à plusieurs niveaux. Entre les centres de prélèvement, le siège de l’EFS et l’ANSM, les données concernant les incidents « machine », comme des particules ou des vibrations, ne remontent pas toujours : la plupart semblent ne pas être jugés importants. Ces problèmes sont évoqués dans un comité central d’entreprise de l’EFS, fin 2017, dont nous avons pu consulter les échanges. « La pratique du reporting dans les régions, notamment en provenance des services de préparation, n’est pas aussi systématique qu’on le croit […] », évoque notamment un médecin. Celui-ci ajoute que des incidents qui se reproduisent ne sont pas toujours signalés lorsqu’ils se répètent :
« Dans certaines régions, faire du reporting est chronophage et procède d’un niveau de complexité qui n’est pas ordinaire. Dans ces conditions, les opérateurs préfèrent ne pas signaler […]. »
« L’attention des médecins/infirmiers est centrée sur le patient : si ce dernier n’a pas de problèmes, la remontée d’un incident du type "bruit de bol" ou "particules" n’en vaut pas la peine », nous raconte un médecin qui a longtemps travaillé dans un EFS.
Suite à cette réunion, l’ANSM affirme avoir resserré son système de signalements. « Nous avons été amenés à demander à l’EFS de déclarer des incidents non déclarables au titre de la réglementation. Donc nous avons eu une vision plus globale », affirme Thierry Thomas. Le reporting semble malgré tout encore insuffisant. En septembre 2018, le syndicaliste Guylain Cabantous se trouvait à Tarbes lorsqu’un bol d’une machine d’aphérèse d’Haemonetics a des fuites. Il découvre alors que plusieurs incidents sont consignés dans un cahier, dont des bruits de scie. Le prélèvement est maintenu ; l’incident ne fait pas l’objet d’une déclaration de matériovigilance.
Les autorités sanitaires ont-elles été complaisantes envers Haemonetics ?
Malgré les alertes et l’accumulation de problèmes, la société Haemonetics a continué à accéder au marché français. Dès 2010, l’EFS se rend compte qu’Haemonetics lui vend des pièces d’occasion pour ses machines, sans les en informer et en les faisant payer au tarif des pièces neuves. Ce sont des pièces parfois usagées qui peuvent contribuer à produire des particules. Le préjudice est évalué par Haemonetics lui-même à un montant, dérisoire selon plusieurs observateurs, de 46 102,65 euros. L’EFS signe un protocole transactionnel en mai 2013, s’interdisant de porter l’affaire en justice, et sans chercher à évaluer le véritable préjudice que les lanceurs d’alertes estiment plutôt à 500 000 euros. La Direction générale de la concurrence, de la consommation et de la répression des fraudes (DGCCRF) estime qu’au regard de la nature des faits, une transmission à l’autorité pénale semblait indispensable [4]. L’EFS ne suit pas son avis. Elle assure aujourd’hui :
« la transaction est une modalité classique et parfaitement légale permettant la résolution rapide des litiges avec un fournisseur. »
En 2017, suite aux plaintes des lanceurs d’alerte et après un article de Mediapart, l’Inspection générale des affaires sociales (Igas) est saisie. Pour les rédacteurs du rapport, qui relèvent quelques dysfonctionnements, la transaction est tout à fait légale et l’EFS a bien géré les relations avec ses fournisseurs. Est-ce un problème qu’Alain Morin, un des rapporteurs, a travaillé avec François Toujas, président de l’EFS et ex-inspecteur de l’Igas [5] ? L’Igas répond en mettant en avant son fonctionnement collégial, qui est « complémentaire de la signature individuelle et de l’indépendance de jugement des inspecteurs missionnés ».
Depuis le 29 janvier 2018, la charte de déontologie des inspecteurs de l’Igas insiste sur la prévention des conflits d’intérêt [6]. Pour ce rapport de 2017, ces précautions ne semblent pas avoir été prises.
Une autre décision de l’EFS a de quoi surprendre. Suite aux problèmes de particules de 2011, l’Établissement français du sang décide de changer de bol de centrifugation afin d’atténuer les vibrations des machines. Ces nouveaux bols vendus par Haemonetics sont plus chers et ont une capacité moindre que les précédents. Un accord prévoit que ces pertes soient compensées par la multinationale du sang. 800 000 euros sont versés sous formes d’avoirs à l’EFS. Mais alors qu’une nouvelle facture d’un million d’euros doit être émise, l’EFS renonce finalement à tout nouveau dédommagement en raison de « contraintes qui lui sont propres ». Un document que nous avons consulté montre qu’Haemonetics avait pourtant prévu de rembourser encore près d’un million d’euros son client. Pourquoi l’EFS a-t-il renoncé à cette somme ? L’Établissement français du sang ne nous a pas répondu.
Secret des affaires
Plus globalement, notre enquête montre que les autorités de santé ne vont pas jusqu’au bout des démarches scientifiques entreprises. Les études qui démontrent que les particules sont probablement des produits chimiques ou des métaux potentiellement cancérigènes sont mises de côté. Dans ses communications, la ministre de la Santé Agnès Buzyn n’évoque pas les conclusions du comité d’experts (CSST) d’octobre 2017, ni celles du laboratoire de Lyon (IBCP). Quand les lanceurs d’alerte demandent la composition du joint, on leur répond que le secret des affaires empêche de la communiquer, avant finalement de transmettre une version publique qui ne comprend pas l’ensemble des composants. Craignent-ils d’alerter les donneurs ?
« L’EFS aurait dû pratiquer le principe de précaution, estime Guylain Cabantous. Nous ne sommes pas dépendants de ces machines. Des plaquettes sont extraites de sang total. Il y a un choix qui a été fait de maintenir ces machines. L’EFS a pris le parti de minimiser la responsabilité exclusive d’Haemonetics. »
Interrogée par Basta! et Radio-France, Haemonetics affirme que ses kits de prélèvement sont « biocompatibes » et « non toxiques pour les humains ». La société explique « qu’il n’existe aucune preuve ou rapport suggérant que le don de plasma ou de plaquettes à l’aide d’une technologie d’aphérèse peut entraîner un cancer ». La réponse intégrale d’Haemonetics est en ligne ici.
Un problème qui dépasse les dispositifs d’Haemonetics ?
Les machines de la société Haemonetics ne sont pas les seules à présenter des particules. En 2017, le Comité scientifique spécialisé temporaire (CSST) avait indiqué que les dispositifs de la société japonaise Terumo, un concurrent d’Haemonetics, contenaient des substances toxicologiquement préoccupantes (des perturbateurs endocriniens comme des phtalates et du bisphénol A), « qui migrent probablement, en partie, dans les produits sanguins pendant l’aphérèse ». Le CSST recommandait une évaluation des risques de ces migrations pour les dispositifs des entreprises concurrentes.
L’ANSM décidera-t-elle d’évaluer réellement les risques présentés par ces dispositifs médicaux ? « L’ANSM est beaucoup trop timorée. Quand on sait qu’il y a ce genre de produits, il faut les éliminer, trouver une alternative. Utiliser des substances clairement toxiques dans les dispositifs médicaux, c’est une hérésie », explique le spécialiste des perturbateurs endocriniens, André Cicolella. En 2016, un Comité scientifique spécialisé temporaire avait déjà été formé pour étudier la toxicité des particules métalliques libérées par les dispositifs médicaux implantables. Lui aussi avait été mis en suspens avant la fin des travaux.
Les machines à plasma d’Haemonetics n’ont été interdites qu’en France. Partout dans le monde, elles continuent à être utilisées.
Simon Gouin avec Sylvain Tronchet (journaliste à la cellule investigation de Radio-France)
Lire le premier volet de notre enquête : Des donneurs de plasma et de plaquettes sont-ils mis en danger par des particules cancérigènes ?